※画像は近日中にすぐに挿入します(2025年8月9日現在)
読んだ後に学びがあったと感じた方は、♡をタップしていただけると嬉しいです。
目次
イオンとは? 基本の考え方をつかもう
📘 陽イオンと陰イオンの違い
イオンとは、電気を帯びた粒子のことです。原子はふつう、陽子と電子の数が等しく電気的に中性ですが、電子を失ったり受け取ったりすると電荷を帯びます。
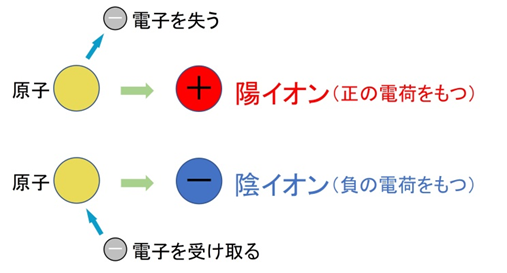
- 電子を失う → マイナスが減り、全体はプラスに → 陽イオン
- 電子を受け取る → マイナスが増え、全体はマイナスに → 陰イオン
【例】
ナトリウム(Na):電子1個を失って Na⁺ に
塩素(Cl):電子1個を受け取って Cl⁻ に
📘 イオン式の読み方・書き方
- 陽イオン:元素名+「イオン」 例)アルミニウム → アルミニウムイオン(Al³⁺)
- 陰イオン:語尾を「〜化物イオン」に変更 例)塩素 → 塩化物イオン(Cl⁻)


イオン化エネルギーの意味と周期表の傾向
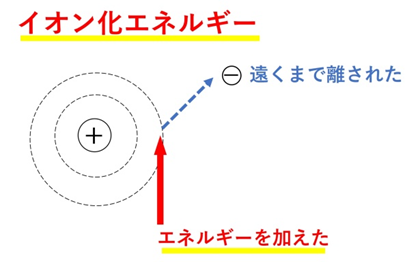
📘 イオン化エネルギーとは?
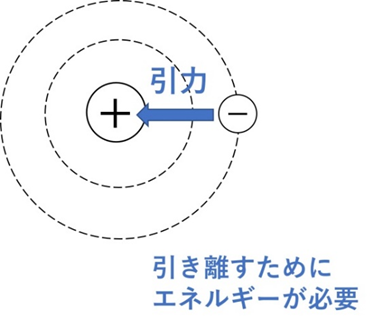
原子から電子を1個取り去って、1価の陽イオンにするために必要な最小のエネルギーです。陽子(+)と電子(−)の間には引力があり、それを振り切るために外部からエネルギーを加えます。
前の単元↓
次の単元↓
📘 イオン化エネルギーの傾向
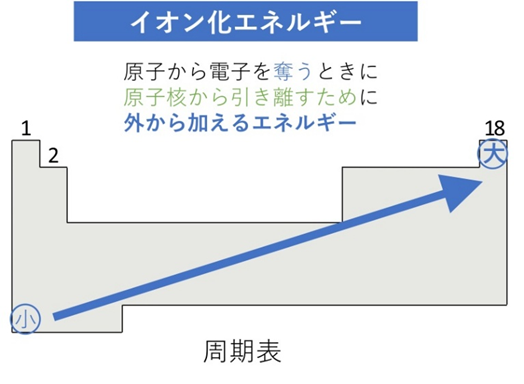
- 横方向(周期):右にいくほど大きい
- 縦方向(族):下にいくほど小さい
理由はこうです。右にいくほど陽子が増え、電子は強く引きつけられます。下にいくほど電子殻が増え、電子が核から遠くなり引力が弱まります。
📘 イオン化エネルギーを左右する2つの要因
- 電子と原子核の距離:遠いほど引力が弱く、電子を取りやすい
- 陽子の数:多いほど引力が強く、電子を引きつけやすい
まとめと次のステップ
イオンの成り立ちとイオン化エネルギーの基本を押さえると、周期表の見方や化学反応の理解が一気に楽になります。ここで紹介したのはほんの一部です。
電子書籍『一問一答 理論化学1』では、今回の内容をさらに詳しく、問題形式と図解で徹底解説しています。次は「電子親和力」や「イオン半径の変化」にも踏み込んでみましょう。化学の世界がぐっとクリアになりますよ。
前の単元↓
あわせて読みたい


【体系解説】原子の構造と電子配置のキホン
※本ナレーションはAIによるプロ声優の音声を使用しています。 一部の化学用語に誤読が含まれることがありますが、ご了承ください。 今後、全編を最適化した高品質ナレー…
次の単元↓
あわせて読みたい


【体系解説】原子とイオンの大きさの決まり方|周期表の縦と横で変わる理由
※本ナレーションはAIによるプロ声優の音声を使用しています。 一部の化学用語に誤読が含まれることがありますが、ご了承ください。 今後、全編を最適化した高品質ナレー…
この記事、どう感じましたか? 感想もらえると嬉しいです(^^)